I naturen findes vanadium i flere oxidationstrin. I magmabjergarter har vanadium oftest oxidationstrinnet +3. Da ionen V3+ har næsten samme ionradius som Fe3+ og Cr3+, kan vanadium erstatte jern og chrom i mineraler som magnetit, chromit, biotit og pyroxen. Indholdet af vanadium i magmabjergarter er størst i basiske bjergarter; basalt indeholder fx op til 1000 g/t. V4+ erstatter Ti4+ i mineraler som ilmenit og rutil. Ved jordoverfladen oxideres vanadium til V5+, som danner vanadationer, (VO4)3-. Disse kan adsorberes på lerpartikler. Lerbjergarter har derfor et vanadiumindhold på op til ca. 100 g/t. Vanadationer udfældes af bly, kobber og zink og danner et stort antal mineraler i malmforekomsters forvitringszoner. Vanadationer har også lighed med fosfationer, (PO4)3-, og udfældes derfor i fosforit, som kan indeholde mere end 9000 g/t vanadium. Olie, asfalt, tjæresand, bituminøse skifre og kul kan have høje koncentrationer, forasket asfalt kan indeholde helt op til 40% vanadium, og alunskifer kan have et vanadiumindhold på mere end 2000 g/t.
Der findes et stort antal mineraler med vanadium som hovedbestanddel, fx oxider, sulfider, silikater og især vanadater; de fleste af disse vanadiummineraler er dannet ved sekundære processer, fx forvitring. Vanadium udvindes som et biprodukt ved brydning af fosforit, jern-, titan- og chrommalme, uranmalme med carnotit samt fra olie, olieskifer og asfalt. De største producenter af vanadium er Kina, Sydafrika og Rusland; i 2013 blev der udvundet i alt 79.000 t. Reserverne anslås at udgøre 15 mio. t vanadium.


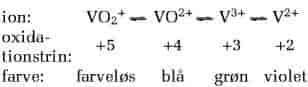

Kommentarer
Kommentarer til artiklen bliver synlige for alle. Undlad at skrive følsomme oplysninger, for eksempel sundhedsoplysninger. Fagansvarlig eller redaktør svarer, når de kan.
Du skal være logget ind for at kommentere.