Bors forbindelser har spillet en vigtig rolle i udviklingen af teorien for kemisk binding. Bor råder over tre elektroner i den yderste skal og skulle således kunne danne tre kemiske bindinger. Der er imidlertid plads til endnu to elektroner uden om boratomets kerne, og dette forhold har spillet en stor rolle i beskrivelsen af borforbindelsernes kemi og struktur.
Halogenforbindelser. Bor danner forbindelser af typen BX3, hvor X er et af halogenerne fluor, F, klor, Cl, brom, Br og jod, I. Der er således en tom plads til et elektronpar; stoffer af den art kaldes elektronacceptorer. De reagerer let med stoffer med et overskydende elektronpar, elektrondonorer, fx baser. Fluoridionen, F-, kan ligeledes reagere med BF3. Ved reaktionen dannes BF4--ionen. I denne danner de fire fluoratomer et tetraeder omkring boratomet, hvorimod BF3 og de øvrige borhalogenider alle har en plan struktur.
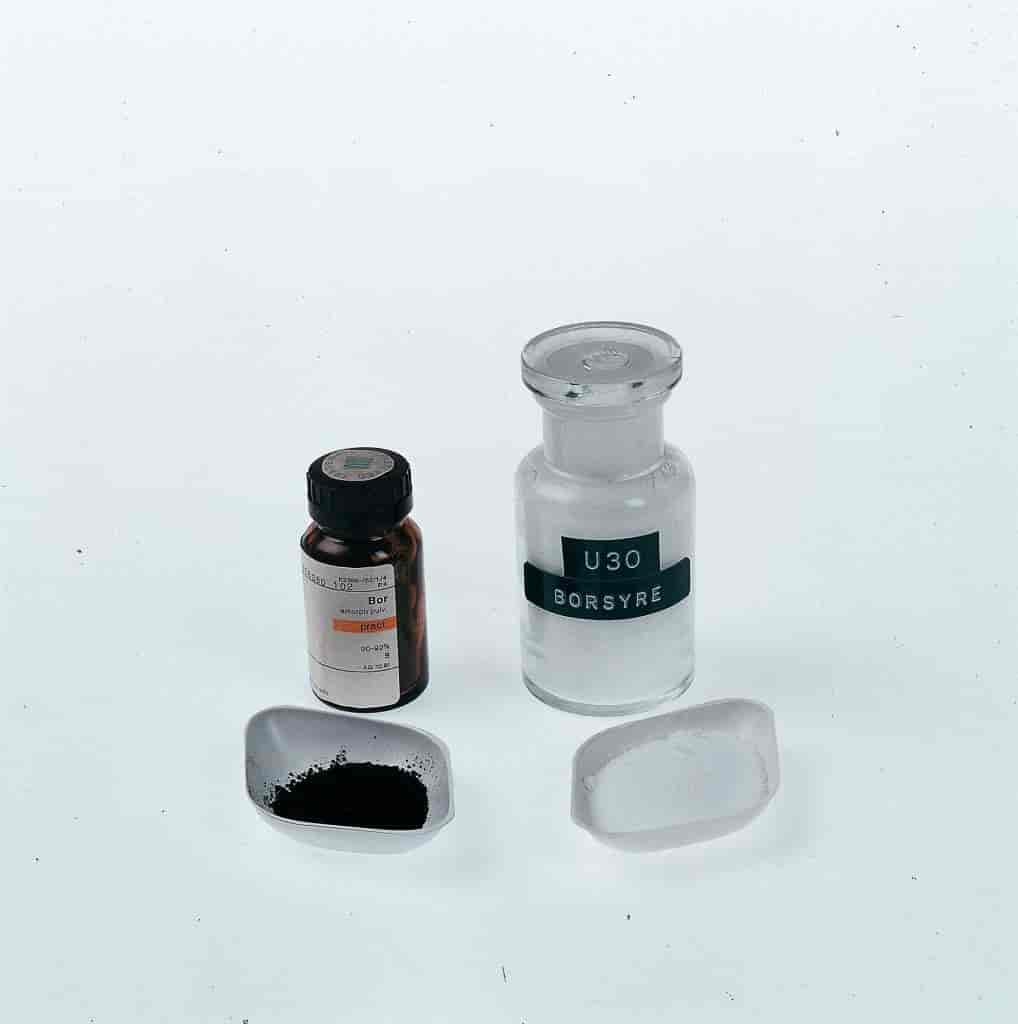
Oxygenforbindelser. I naturen forekommer bor altid bundet til oxygen. Orthoborsyre, B(OH)3, er en elektronacceptor med plan struktur. Den er en meget svag syre, men reagerer med hydroxidionen, OH-, og danner B(OH)-4, der har en tetraedrisk struktur. Orthoborsyre er opløselig i vand; en 3 % opløsning i destilleret vand kaldes borvand. Opløsninger af borsyre har en svag antiseptisk virkning. Ved opvarmning danner orthoborsyre bortrioxid, B2O3, der er et farveløst, glasagtigt stof. Ved sammensmeltning af bortrioxid og metaloxid dannes borater. De fleste borater, der forekommer i naturen, optræder dog som polyborater.
Et eksempel herpå er boraks (tinkal), der har formlen Na2B4O7∙10H2O.
Nitrogenforbindelser. Da bor har tre og nitrogen fem elektroner i yderste skal, råder sammensætningen BN over fire elektroner pr. atom. Dette forhold giver mulighed for dannelse af forbindelser, der er analoge med carbons. Bornitrid, BN, findes i to former: en med en lagdelt struktur, der minder om grafits, og en anden, borazon, med en struktur, der er analog med diamants. Borazon har da også en hårdhed som diamant. I borazin, B3N3H6, ligger alle atomerne i en plan ligesom i benzen, og de to forbindelsers fysiske egenskaber afviger kun lidt fra hinanden.
Hydrogenforbindelser. Den teoretisk simpleste boran (forbindelse mellem bor og hydrogen) skulle have formlen BH3. En sådan forbindelse kendes ikke i ren form, men diboran, B2H6, og en række andre boraner, fx B4H10, B5H9, B5H11 og B10H14, er kendte. Forbindelsen natriumborhydrid, Na[BH4], er et vigtigt syntesehjælpemiddel, bl.a. i den organiske kemi.
Borider. Forbindelser mellem et metal og bor kaldes borider; de er ofte forbindelser med et højt smeltepunkt og med komplicerede sammensætninger og strukturer.





Kommentarer
Kommentarer til artiklen bliver synlige for alle. Undlad at skrive følsomme oplysninger, for eksempel sundhedsoplysninger. Fagansvarlig eller redaktør svarer, når de kan.
Du skal være logget ind for at kommentere.