Tilstandsligning, sammenhæng mellem termodynamiske variable i gasser, væsker eller faste stoffer. For en ideal gas er sammenhængen mellem tryk, temperatur og rumfang særlig simpel, idet produktet af trykket p og volumenet V er proportionalt med den absolutte temperatur T, udtrykt ved idealgasloven: pV = nRT. Her er n antallet af mol gas, mens R er gaskonstanten.
Afvigelser fra denne idealgaslov skyldes atomernes eller molekylernes vekselvirkning. Johannes Didrik van der Waals opstillede i 1873 på empirisk grundlag en tilstandsligning, der tager hensyn til denne vekselvirkning og giver en kvalitativ beskrivelse af virkelige gassers egenskaber. Van der Waals' tilstandsligning har udseendet
Det første led med konstanten a er et udtryk for de kræfter, der virker mellem partiklerne og derved ændrer trykket, mens det andet led med konstanten b tager højde for, at det frie volumen er reduceret pga. partiklernes eget volumen. De to stofspecifikke konstanter kan bestemmes eksperimentelt.
En systematisk teoretisk behandling af vekselvirkningen fremkommer ved den såkaldte virialudvikling, der fører til en tilstandsligning af formen, hvor de temperaturafhængige størrelser B og C betegnes virialkoefficienter og ligeledes kan bestemmes eksperimentelt.


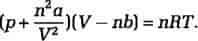
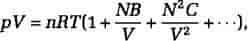


Kommentarer
Kommentarer til artiklen bliver synlige for alle. Undlad at skrive følsomme oplysninger, for eksempel sundhedsoplysninger. Fagansvarlig eller redaktør svarer, når de kan.
Du skal være logget ind for at kommentere.